Elektroliz
Elektroliz nedir?
Elektrik akımı yardımıyla, bir sıvı içinde çözünmüş kimyasal bileşiklerin ayrıştırılması işlemine elektroliz denir. Bu değişiklik, maddenin elektron vermesinden (yükseltgenme); veya almasından (indirgenme) kaynaklanır. Elektroliz işlemi, elektroliz kabı ya da tankı denen bir cihaz içinde uygulanır.
Bu aygıt, çözünerek artı (+) ve eksi (-) yüklü iyonlara ayrılmış bir bileşiğin (→Elektrolit) içine birbirine değmeyecek şekilde daldırılmış iki elektrottan meydana gelir. Elektrotlar bir akım kaynağına bağlandığında oluşan gerilim (elektriki alan), iyonları karşıt yüklü elektroda (kutup) doğru hareket ettirir. Karşıt kutupta yükünü dengeleyen atom veya moleküller elektrotta çökelir veya elektrolit içindeki moleküllerle yeni reaksiyonlara girer. Yeni reaksiyona girme eğilimi daha fazladır.
Örnek olarak sofra tuzu içeren elektrolitte anotta klor açığa çıkarken nötr sodyum atomları su moleküllerini etkiliyerek katottan hidrojen açığa çıkmasına neden olurlar ve elekrolitte sodyum hidroksit meydana gelir.
Elektroliz bu akımın elektrolit içerisinde iletilmesi ile birlikte gelişir. Elektrolit çoğu kez erimiş olarak veya bir tuz eriyiğinin sulu çözeltisi şeklindedir. Volta pilinin (1800) bulunması ile ve suyun elektrolizine uygulanmasıyla ilgili deneyler 19. Yüzyılın başlarında gerçekleşmiştir. Elektroliz olayını özel olarak inceleyen, Michael Faraday tarafından ortaya atıldığı düşünülmektedir.
Elektroliz ile İlgili Bazı Terimler
Elektrot, elektrolit (çözelti), elektroliz tanımları:
İyon nedir? Suda çözülebilen kimyasal bileşiklerin bir kısmı negatif ve pozitif yüklü, atom veya atom gruplarına ayrılırlar. Pozitif ve negatif yüklü bu parçacıklara göç eden anlamına gelen iyon denir.
İyonlaşma nedir? Bir bileşiğin iyonlarına ayrışmasına iyonlaşma denir. Örneğin gümüş nitrat iyonlaşırsa; AgNO3→Ag+NO3 gümüş ve nitrat kökü iyonlarına ayrılır.
Genel olarak; asitlerin (sülfirik asit=zaç yağı, nitrik asit= kezzap, hidroklorik asit= tuz asidi), bazların (sodyum hidroksit= sud kostik, potasyum hidroksit= potas kostik), tuzların ( bakır sülfat=göz taşı, gümüş nitrat= cehennem taşı) sudaki çözeltileri kendiliğinden iyonlaşırlar. İyonlaşan çözeltiler ise elektrik akımını iletirler.
Elektrot; Elektrolit içine batırılan iletken metallerdir. Suya daldırılan iletkenlerdir. Örnek, grafit çubuğu.
Elektrolit nedir? Çözelti olarak veya ergimiş halde alındığında alındığında doğru akımı geçiren maddeye elektrolit denir. Elektrolitlerin içerisinde serbest iyonlar vardır. Elektrolit, sulu çözeltide elektriği ileten maddedir. Örnek olarak , hidroklorik asit (HCl) sülfirik asit (H2SO4), nitrik asit (HNO3) çözeltileri.
Elektroliz hücresi (voltametre); İki elektrolit çözeltinin birlikte olduğu ve elektroliz olayının meydana geldiği hücreye elektroliz hücresi denir.
Anot nedir? Elektroliz kabında, üretecinin pozitif (+) kutbuna bağlı elektroda anot adı verilir.
Katot nedir? Elektroliz kabında, üretecinin eksi (-) kutbuna bağlı elektroda katot adı verilir.
Anot katot; Anot pozitif (+) yüklü, katot negatif (-) yüklü elektrotlardır.
Anyon nedir? Atomların elektron almış durumudur. Negatif yükle yüklü atom ya da atom gruplarına anyon denir.
Katyon nedir? Atomların elektron vermiş durumudur. Pozitif yükle yüklenmiş atom ya da atom gruplarına katyon denir. Elektrik enerjisinin, kimyasal reaksiyon meydana getirmesi için tam kapalı bir devre elektrik akımı gerekir.
Elektroliz Olayı
Elektroliz olayını anlamak için ilk önce bileşikler arasındaki bağları (bileşikleri bir arada tutan kuvvet) öğrenmek gerekir. Bileşikler arasında değerlik elektronuna bağlı iki tür bağ vardır.
Kovalent bağ: Kovalent bağda bileşikler elektron veya elektronları ortak kullanırlar.
İyonik bağ: Bileşik atomlarından (veya moleküllerden) biri diğerine elektron vererek kendisi pozitif iyon durumuna gelir. Diğer atom veya bileşik ise negatif iyon durumuna geçer.
Kovalent bağlı bileşikler elektrik alanı ile ayrıştırılamazlar. Buna karşın iyonik bağlı bileşikler elektrik alanı ile (potansiyel fark uygulanarak) ayrışabilirler.
Elektrolizin yapıldığı kaba elektroliz kabı (Voltmetre) denir. Doğru akım üretecinin pozitif kutbuna bağlanan elektroda anot, negatif kutbuna bağlanan elektroda ise katot adı verilir. Bir elektroliz için doğru akım güç kaynağı, elektrotlar ve elektrolit gerekir.
Elektroliz farklı amaçlar için farklı şekillerde yapılabilir. Örnek olarak, bir metal başka bir metal ile kaplanacaksa kullanılacak eriyik ve elektrotlar ona göre seçilmelidir. Veya su ayrıştırma ile Hidrojen gazı elde edilmek istendiği zaman farklı bir çözelti ve farklı elektrotlar kullanılır.
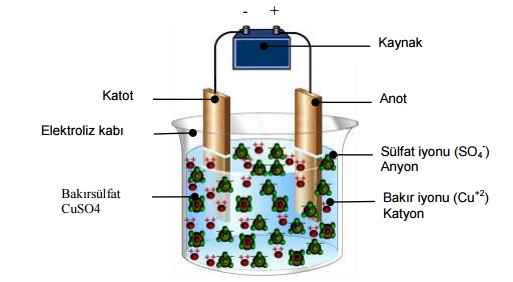
Elektroliz olayının nasıl gerçekleştiğini anlamak için aşağıda şekildeki düzenek bir örnektir. Bu düzenek, kaynağın eksi ucuna bağlanmış olan malzemenin (katot) kaynağın artı ucuna bağlanmış olan malzeme (anot) ile kaplanması için tasarlanan bir düzenektir.
Elektroliz kabının içindeki suya bakırsülfat (CuSO4) karıştırılmış ve bakırsülfat, bakır (Cu+2) ve sülfat (SO4 -2 ) şeklinde suda çözünerek iyonlarına ayrılmıştır. Sisteme enerji verildiği zaman kaynağın artı (+) ucu anottan elektron çekerken eksi (-) ucu ise katoda elektron verir. Anotta negatif iyon durumuna geçen bakır atomları (Cu-2 ) çözeltide serbest halde bulunan sülfat iyonları (SO4 -2) ile birleşerek bakırsülfatı (CuSO4) meydana getirirler. Bu sıradada çözeltide serbest halde bulunan pozitif bakır iyonları (Cu+2) katottaki fazla elektronları alarak katotla birleşirler. Bu şekilde akım geçtiği sürece katottaki metal, anottaki metal ile kaplanmış olur. Zamana ve devre akımına göre kaplanan bakırın miktarı Faraday Yasaları ile açıklanabilir.
Elektroliz Deneyi
Bakır sülfattan bir miktar alalım, arı suda çözdürelim, bakır sülfat çözeltisi hazırlayalım. Çözeltinin içine elektrolitik bakır ile bir de ham bakır daldıralım. Ham bakırın ucunu bir pil bataryasına pozitif (+) kutbu olan anota elektrolitik bakırın ucunuda üretecin negatif (-) kutbu olan katota bağlayalım. Bir süre sonra elektrotlara bakalım. Anot olan ham bakır delik deşik olur, kütlesi azalır. Buna karşılık bakır tel kalınlaşır, üzerinde saf bakır toplanır.
Bakır sülfatın elektrolizi
Bakır sülfat çözeltisi; CuSo4→ Cu + So4 pozitif yüklü bakır, negatif yüklü sülfat kökü iyonlarına ayrışmış olduğundandan doğru akım geçince elektrolize uğrar.
Pozitif yüklü bakır iyonu katottan iki elektron alarak nötrleşir ve atom durumuna geçer, katotta toplanır. Onun için kattot ağırlaşır. Negatif yüklü sülfat kökü iyonu ise ham bakır olan (+) yüklü anota gider, iki elektron vererek serbest hale geçer, bakır sülfat yapar, bu tuz ise suda çözünür, onun için ham bakırda azalma olur. Kattota toplanan bu bakıra elektrolitik bakır denir. Elektrolizde doğru akım kullanılır. Şiddeti ve yönü belli olan doğru akımda iyonlar kolaylıkla göç hareketi yapabilirler. Elektrolizde alternatif akım kullanılacak olursa iyonlar göç hareketi yapmaya zaman bulmadan akımda yön değişmesi olur. Onun için alternatif akım kullanılmaz. Ancak alternatif akım doğru akıma çevrilir, ondan sonra kullanılabilir.
Elektrolizin Endüstrideki Kullanım Alanları
- Elektroliz, elektrolizle metalürjilerde, metallerin hazırlanmasında (çözünmez anot) veya arıtılmasında (çözünür anot) kullanılmaktadır.
- Elektroliz, galvanoplastide, bir elektrolitik metal birikimiyle metal birikimiyle döküm kalıbına şekil vermede, aşınmaya karşı korumada, bir metal çökeltisi ile metallerin kaplanmasında (örneğin, kadmiyum kaplama altın veya gümüş kaplama, nikelaj kaplama, çinko kaplama, krom kaplama, çinko kaplama, bakır kaplama) kullanılan bir yöntemdir.
- Suyun elektrolizi ile arı hidrojen ve başka gazlar elde etmede.
- Elektrolizin diğer uygulamaları, metallerin anot veya katot anot olarak yağlardan temizlenmesi (alüminyumun, alümin sayesinde anotlaştırılması) elektrolizle parlatma, gaz üretimi (klor) gibi.
- Elektroliz, voltmetrelerdeki akım miktarının, akım şiddetlerinin ölçülmesine de imkan sağlar.
- Devamlı akım sayesinde, organik dokuların ayrıştırılmasına dayanan tedavi elektrolizi, yemek borusu ve idrar yolu (üretra) daralmalarının, burun deliklerindeki poliplerin yok edilmesinde, cerrahide sinir uçlarının (nöronların), sertleşen urların vs hastalıkların tedavisinde kullanılmaktadır.
Elektroliz Yardımı İle Elde Edilenler
- Alüminyum, ergitilmiş alüminyum oksitin elektrolizinden elde edilir.
- Klor-alkali fabrikalarında sodyum ve klor; ergitilmiş yemek tuzunun elektrolizinden elde edilir.
- Metallerin ayrıştırılmasında elektrolizden yararlanılır. Hangi metalin ayrıştırılması isteniyorsa, o metalin bir tuzunun çözeltisi hazırlanır. Saf olarak elde edilmek istenen metaller bu metallerin suda çözünen tuzlarının elektrolizinden elde edilir. Bu sistem elektrolitik bakır metali için kullanılır. Çözelti içerisine batırılan elektrotlardan biri saf bakır, öbürü de saf olmayan bakırdır. Bakır iyonları (+) yüklü olduğu için katoda gider orada nötrleşerek saflaştırılmış olur.
- Metalle kaplamacılıkta elektrolizden faydalanılır. Kullandığımız araç ve gereçlerin üzerlerini çevreden etkilenmemesi için korumak gerekir. Herhangi bir cisim metalle kaplanmak istenirse elektroliz kabında katot olarak kullanılır. Hangi metal ile kaplanacaksa o da anot olarak seçilir. Havadan etkilenmeyen metallerin tuzunun, suda çözünen tuzları alınır. Nikelaj, kromaj ve gümüşle kaplama bu yöntemle olur. Böylece herhangi bir cismin üzerine nikel, gümüş, bakır, altın, krom kaplanabilir. Bir demir boru nikelle kaplanacak olursa, boru katot, nikelse anot olarak seçilir. Çözelitisi için nikel tuzu çözeltisi kullanılır. Sulu çözelti içerisindeki nikel iyonları katoda gider ve element halinde toplanarak elektroliz kaplama olayı gerçekleşmiş olur. Bu işleme endüstride galvanoteknik denir.
Elektrolizi Kim Buldu?
Elektroliz konusundaki 18oo’ de Anthony Carlisle ve William Nicholsun 1807’ de Humphry Davy ve 1833’ de Faraday’ın keşifleri ve, 1887’ de Svante Arrhenius tarafından geliştirilen iyon teorisi, günümüzün atom fiziğine temel oluşturmuşlardır.
Elektrolizi, Michael Faraday bulmuştur. (Southwark – Hampton Court 1791-1867) Michael Fraday, Londra’da iş hayatına atılarak bir kitapçıda çalışmış, sonra bir ciltçinin yanında çırak olmuştur. Burada birçok kitap okuma okumuştur. İlgi alanını elektrik ve kimya çekmiştir. Çalışırken geceleri Davy’nin Royal İnstitution’da derslere katılarak bilimsel konferansları izlemiştir. Davy Faraday’a Royal İnstitution’da asistanlık görevi verilmiştir. Faraday aynı yerde 1825’te laboratuvar müdürü, 1833’te de kimya profesörü olmuştur.
Kimya araştırmalarından ilki maden kömürü katranlarında benzeni bulmaktı. Basit bir cihazın içerisinde sıkıştırma ve soğutmayla, o çağda bilinen tüm gazları sıvılaştırmayı başardı. Qersted’in icatından sonra 1824 senesinde elektromanyetikliği incelemeye başlamıştı, bir mıknatısın elektrik akımı üzerindeki etkisini gözlemleyerek Ampére’in teoremlerini tamamlamıştır. Bu yolla, devamlı mıknatısların etkisinde olan bir elektrik devresini döndürmeyi başararak elektrik motorunu çalıştıracak prensibi bulmuştur.1831’de, mekanik enerjiyi elektrik enerjisine çeviren elektromanyetik indüklemeyi bulmuş ve dinamo yapımını sağlamıştır. 1833’te elektroliz teorisini ortaya atarak; olayın ismini, elektrot ve iyon terimlerini ortaya atmıştır.
Faraday adını taşıyan nitelik ve nicelik kanunlarını belirlemiştir. Sonra elektrostatikle uğraşmış 1843’te elektroskopa bağlı silindir yardımıyla elektriğin korunumu kanununu doğrulamıştır. Etkiyle elektriklenme teorisini ortaya koymuş; çukur bir iletkenin ( Faraday kafesi) elektrostatik etkilere ekran meydana getirdiğini göstermiştir. 1846’da elektrostatik enerjinin, dielektriklerde yerleştiğini bulmuştur. Bu buluşu Maxwell’in elektromanyetiklik kuramını geliştirmesine yardımcı olmuş ve elektrikle Hertz dalgaları arasındaki bağıntıları açıklamıştır. Aynı buluşla yalıtkanların özgül indükleme gücünü tanımlamıştır. 1838’de elektro-ışıldama olayını bulmuştur. Son buluşları ise 1845 yılında polarize ışığın manyetik alan üzerindeki etkisi de diyamanyetiklik olmuştur.
Michael Faraday’ ın başlıca eserleri:Kimya ve Fizikte Deneysel araştırmalar,1850 (ExperimentalResearches In Chemistry and Physics ) Elektrikte Deneysel Araştırmalar,1839-1855(Experimental Researches In Electricity)
Faraday Elektroliz Deneyi
Elektroliz olaylarından alınan sonuçlara göre elektroliz kanunlarını inceleyen bilgin “M. Faraday”dır. Faraday 1830 yıllarında kimyasal bileşiklerin sulu çözeltisinden elektrik akımı geçirmiştir. Sulu çözeltisinden elektrik akımı geçirilen maddenin kimyasal yapısında farklılık oluştuğunu tespit etmiştir.
Elektrik akımı uygulanan maddelerin bileşenlerine ayrışarak anot (+ yüklü elektrot) ve katotta (- yüklü elektrot) toplandığını göstermiştir. Elektrik enerjisi kullanılarak sıvı içerisinde çözünmüş kimyasal bileşiklerin elementlerine ayrıştırılması işlemine“elektroliz” denir. Asit, baz ve tuzlar sıvı halde veya çözeltileri elektrik akımını iletirler.
Güç kaynağının;
- (+) ucuna bağlanan elektrot → anot
- (-) ucuna bağlanan elektrot → katot
Açığa çıkan maddeler;
- Katı ise → elektroda yapışarak elektrodun kaplanmasını sağlar.
- Gaz ise → ortamı terk eder ya da kapalı bir kapta su üzerinde toplanabilir.
Elektrolizde çeşitli bileşiklerin çözeltilerine elektrik akımı uygulanmış (-) yüklü elektrotta (katotta) bileşiği meydana getiren (+) yüklü iyonlar element halinde elde edilmiştir.
Katotta belirli bir miktar madde biriktirmek için gereken yük miktarı daima sabit bir değere eşittir.
Faraday bir elektrolizde katotta toplanan madde miktarının devreden geçen elektrik miktarı ile doğru orantılı olarak arttığını görmüştür. Yine bir elektroliz kabından 96.500 kulonluk bir elektrik miktarı geçirildiği zaman katotta toplanan maddenin gram olarak değerinin o elementin kimyasal eşdeğer ağırlığına eşit olduğunu kanıtlamıştır. Bir elementin eşdeğer ağırlığı ise; o elementin atom kütlesinin onun birleşme değerine bölümü demektir.
Faraday Yasası
İlk defa elektroliz olayını inceleyen M. Faraday, elektroliz hücresinden geçen akım miktarıyla ayrılan madde miktarı arasındaki ilişkiyi gösteren iki kanunu sundu. Bu kanunlara Faraday kanunu (Faraday yasası) adı verilmiştir. Bu kanuna göre:
Elektrolitik bozunma ürünlerinin miktarı (m), elektroliz hücresinden geçen akım miktarı ( Q ) ile doğru orantılıdır. Buna göre I akım şiddeti, t zaman denildiğinde;
M= CQ = C x I x t
- m: madde miktarı (g)
- C: orantı katsayısı
- t: zaman (saniye)
- I: akım şiddeti (amp, coulomb sn-1) bağıntısı yazılır.
Elektroliz ürünlerinin miktarı ve ürünlerin meydana gelme hızı elektroliz şartlarına bağlıdır. Faraday kanunu‘ na göre:
- Elektrolitten elektrik akımı geçirildiği zaman serbest hale geçen veya çözünen madde miktarı elektrolitten geçen elektrik yükü ile doğru orantılıdır.
- Çeşitli elektrolitlerden aynı miktar elektrik akımının geçirilmesi ile ayrılan veya çözünen madde miktarı, bu cismin kimyasal eşdeğeri ile doğru orantılıdır. Bir cismin kimyasal eşdeğeri, bir kulonluk (coulomb) elektrik yükü miktarının serbest hale geçirdiği veya çözdüğü maddenin gram miktarıdır.
Coulomb nedir?
Faraday’ ın elektrik miktarının ve elektrik şiddetinin birimlerini tanımlar. Coulomb, AgNO3 (gümüş nitrat)’lı bir voltmetreden geçtiğinde 1,118 mg. gümüş açığa çıkar.
1 coulomb’luk akım bir gümüş kulonmetresinde 1,118 mg gümüş ayıran akım olarak tanımlanmaktadır.
Gümüşün değerliği bir olduğu için eşdeğer ağırlığı atom ağırlığına eşit ve 107,870 g/mol veya g/eşdeğer gram olur. Buna göre bir eşdeğer gram gümüşü açığa çıkaran akım miktarı;
olur.
Eşdeğer gram:
Bir elementin, 1 atom gr hidrojenle veya ½ atom gram oksijenle birleşebilen miktarı veya bir maddenin 1 mol elektron alabilen yada verebilen miktarı olarak tanımlanmaktadır.
1 eşdeğer gram = atom ağırlığı / değerlik
Değerlik;
- Baz ve asitlerde ve çözeltiye verilen H++ yada OH– sayısına eşittir.
- Yükseltgen ve indirgenlerde verdiği veya aldığı elektron sayısına eşittir.
- Tuzlarda toplam negatif yada pozitif yük sayısına eşittir.
Faraday’ın İkinci Kanunu‘ na göre değişik maddelerin birer eşdeğer gramlarını açığa çıkarmak için gerek olan akım miktarı 9,649.104 coulombdur ki buna Faraday sabiti denir. Faraday sabiti “F” ile gösterilmektedir. Genel olarak bu sabit 96500 coulomb olarak alınır.
Elektroliz hücresinden bir faradaylık akım geçtiği zaman ayrılan madde miktarı, “z” değerlik, “M” mol ağırlığı, olmak üzere m= M / z olur.
Bu bağıntı birinci faraday kanununda yerine konulduğunda m= M x I x t /zF denklemi elde edilir.
Soru: 5 dakikada 1,00 amperlik bir akımla erimiş(sodyum klorür) NaCl’ün elektrolizinden kaç gr klor elde edilir?
Çözüm
Verilenler
I = 1 amp. = 1 coulomb/ sn
t = 5 dakika = 5. 60 = 300 sn
z = 1
M = 35,5 g
F = 96500 coulomb verilen değerleri Faraday kanunlarının son formülüne uyguladığımız zaman
m = M x I x t / zF
m = 35,5 x 1 x 300 / 1 x 96500
m = 0,110 g klor elde edilir.
Soru: CuSO4 elektrolizinde, devreden 12 dakikada 0,500 akım geçmektedir. Bu süre içinde katotta toplanan bakır miktarını bulunuz.
Çözüm
Verilenler
I = 0,500 amp = 0,500 coulomb/ sn
t = 12 dakika = 12 . 60 = 720 sn
M= 63,5 g
F= 96500 coulomb
m= M x I x t / zF
z = 2
m = 63,5 x 0,500 x 720 / 2 x 96500
m = 0,1184 g
Faydalı bilgiler : Kablo Seçim Cetveli | PLC | HMI | SCADA | Endüstri 4.0 | Servo motor | AC motor | Step motor | DC motor | Loadcell | Konveyör | Profinet | Direnç değeri okuma |







Yorum Yok