Elektron
Elektron nedir?
Elektron/Elektra yada eksicik, en küçük eksi (-) yüküne sahip ana parçacıktır. Elektron/Elektra kelimesi kehribarın Antik Yunancadaki ismi (elektron/elektra) gelmektedir. Eski Yunanda, kehribarın sürtünmesiyle statik elektrik ile yüklendiği biliniyordu.
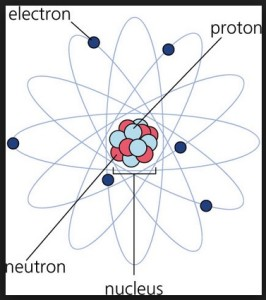
Atomun üç bileşeninden biri elektron (diğerleri ise proton ve nötrondur). Atomu maddenin en küçük birimi kabul eden teori ile, elektriğin taneciksel bir yapı içinde bulunduğu sonucuna varılır. En küçük elektrik yükü taşıyan ve atomu meydana getiren bu tanecik elektrondur. Atomun yapısında, çekirdeğin etrafında hareket edebilen elektronlar negatif yüklü parçacıklardır. Çekirdeği elektrik yükünden meydana gelen zırh şeklinde kuşatmışlardır. Elektronlar çekirdeğin etrafında döndükleri gibi kendi etraflarında da dönerler.
Bir atomu dünya büyüklüğüne getirdiğimiz zaman elektron bir elma kadar olur. Elektronlar çekirdeğin içinde olan nötron ve protonların iki binde biri kadar küçüktür. Atomlar o kadar küçüktür ki örnek olarak bir toz şekerinin bile atomlarını saymak için milyonlarca yıl gerekmektedir. Elektronlar incelendiğinde tanecik değil dalga özelliği gösterirler. Tüm atomların dış bölümü elektron tabakalarından meydana gelir ve her tabaka çekirdekten uzaklığına göre K, L, M. gibi harflerle adlandırılmaktadır.
Atomun etrafında katman katman yörüngeler vardır. Bu yörüngelerde elektronlar bulunur. Yörünge “n” harfi ile gösterilir. Yörüngede olan en fazla elektron sayısı 2n2 formülü ile bulunur. aX: a, X atom numarasını belirtir. Bunlar K, L, M, N,… gibi harflerle gösterilirken aynı zamanda 1, 2, 3, 4,… gibi numaralarla da gösterilir. Bu numaralara baş kuantum sayısı adı verilir. Yörüngelerinde kendi içlerinde alt birimleri vardır. Bunlara orbital adı verilir.
Çevrede bulunan elektronların sayısı ve konumu, o elementin kimyasal nitelikleri ile, özellikle değeriyle ilişkilidir. Birçok durumda, bu elektronlar maddeden çıkarılıp az veya çok büyük bir hızla, bir elektrik alanı ile, harekete geçirilerek boşlukta yayılabilir. Boş bir tüple elde edilen katot ışınları; radyoaktif cisimlerin beta ışınları; ışığın metalleri etkileyerek çıkardığı elektrik, vb.
Normal şartlarda elektronlar atomun artı yüklü çekirdeğine bağlı halde bulunur. Nötr bir atomdaki elektronların sayısı, çekirdekteki artı yüklerin sayısına eşittir. Fakat bir atomda artı yüklerin sayısından daha fazla veya daha az elektron bulunabilir. Bu halde atomun toplam yükü eksi ya da artı olur; böyle yüklü atomlara iyon denir. Bir atoma bağlı olmayan elektronlara serbest elektronlardır.
Belirli bir atomdaki elektronlar çekirdek çevresinde düzgün bir şekilde sıralanmış yörüngemsiler üzerinde dolanır. Elektronlar ile çekirdek arasındaki çekim kuvveti, elektronların kendi aralarındaki itme kuvvetine üstün geldiği için, elektronlar normal şartlarda atoma bağlı kalır. Elektronları üzerinde dolandığı yörüngeler kendi aralarında kümelenerek kabukları meydana getirirler. Çekirdeğe en yakın yörüngemsilerdeki elektronlar atoma en sıkı bağlı olanlardır.
En dış yörüngelerdeki elektronlarsa çekirdekle aralarındaki diğer elektronların perdeleyici etkisi sebebiyle atoma en gevşek bağlı haldedir. Elektronlar, atom yapısı içindeki hareketlerinde, atomun tüm hacmini kaplayan dağınık bir eksi yük bulutu meydana getirirler. Bu nedenle atomun büyüklüğünü elektronların atom içindeki diziliş şekli belirler. Atomun, başka atomlar, parçacıklar ve elektromagnetik ışıma karşısındaki davranışını da elektronların bu diziliş şekli belirler.
Elektronlar statik ve dinamiktir.
İşte bu statik ve dinamik elektronların meydana getirdiği fiziksel oluşuma elektrik denir. Birçok yalıtkan malzemelerde (tahta, cam, plastik, hava gibi) elektronlar atomlara sıkıca bağlanmıştır. Bu malzemelerde elektronlar hareket etmezler. İletken malzemelerde (altın, bakır, gümüş, alüminyum v.b.) elektronlar atomlarından ayrılıp hareket edebilirler. Bu elektronlar serbest elektronlardır. İletkenler üzerindeki serbest elektronlar elektriği bir noktadan diğer bir noktaya kolaylıkla taşırlar.
Serbest elektronlar; Çekirdeğe yakın yörüngelerde bulunan elektronlar çekirdeğe sıkıca bağlıdır. Atomların dış yörüngelerinde bulunan elektronlara “valans elektron” ya da “serbest elektron” denir. Çekirdeğe bağları zayıf olduğu için az bir enerji sonucu atomu bırakabilirler. Hareket özelliklerinden dolayı elektriğin iletilmesinde büyük rolleri vardır.
Elektronların Özellikleri
- Elektronların çekirdek çevresinde dönme hızı, 2,18.108 cm/sn’dir.
- Elementlerin çekirdekte bulunan protonlar, atomun (o elementin) bütün kimyasal ve fiziksel özelliklerini belirler.
- Proton sayısı atomlar (elementler) için ayırt edici bir özelliktir. Proton sayısının farklı olması elementin diğerinden farklı olduğu anlamındadır.
- Elektronların bulunma ihtimalinin olduğu bölgelere “elektron bulutu” denir.
- Kimyasal olaylarda sadece elektron sayısı değişir. Proton ve nötron, çekirdekte bulunduğu için sayıları değişmez.
- Nötr bir atom için; elektron sayısı= proton sayısı
- Atom numarası= proton sayısı
- Çekirdek yükü= proton sayısı
- İyon yükü= proton sayısı – elektron sayısı
- Kütle numarası= proton + nötron sayısı
- Atom Numarası = Proton Sayısı = Çekirdek Yükü = Elektron Sayısı
Elektronun Keşfinin Tarihsel Gelişimi
Elektriğin hep bir elektrik biriminin katları şeklinde ortaya çıkması, araştırmacıları, elektriğin “bölünmeyen parçacıklardan meydana geldiği” olarak düşündürmüştür.
1755 yılında Franklin, elektriğin de madde gibi süreksiz bir yapısı olduğu fikrini ileri sürmüştür.
1833’ de Faraday’ın elektroliz kanunlarından olumlu sonuç çıkmıştır. Faraday, bir elektrolitten elektrik akımı geçirildiği zaman elektrotlardan ayrılan madde miktarının elektrolitten geçen elektrik miktarıyla orantılı olduğunu, değişik elektrolitlerden aynı miktar elektriğin geçmesi ile ayrılan madde miktarının her cismin eşdeğer gramıyla orantılı olduğunu bulmuştur
William Crooks tarafından atomdaki negatif yüklere ait ilk kanıt 1870’lerde ortaya kondu. Crooks’ın yaptığı katot ışını tüpü deneyinde görülen sarı-yeşil renkteki ışımalar elektronlardır. Bu yüklere 1891 yılında G.J.Stoney elektron demiştir.
J.J. Thomson yaptığı deneyler sonucu bu parçacıkların tüm atomlarda olduğunu gösterdi ve elektronların yük/kütle oranını hesapladı (-1,7588 1011 C/kg)
Millikan ise yaptığı yağ damlası deneyi ile elektronun yükünü ölçtü ve Thomson’ın bulduğu eşitlikte yerine koyarak kütlesini hesapladı.
Elektron’un Keşfi
Maddenin yapısına ilk olarak modern yaklaşım Thomson’un katot ışınlarını inceleyerek elektronun keşfi ile başlamıştır. Thomson: elektriksel gerilim uygulanan katot ışınları tüpünde katot ışınların negatif kutup tarafından itildiğini pozitif kutba doğru çekildiğini belirledi.
- Aynı cins elektrik yüklerinin bir birini itmesi ve farklı yük elektrik yüklerinin birbirini çekmesi sebebi ile Thomson katot ışınlarının negatif elektrik yüklerinden olduğu sonucuna vardı.
- Thomson yaptığı deneyinde katot için farklı madde kullandığında ve deney tüpünün farklı gazla doldurulduğunda da katot ışınlarının aynı davranışta olduğunu gördü. Bu durumda elektronun maddenin cinsinin karakteristik bir özelliği olmadığını bütün atom cinsleri için elektronun her birinin aynı olduğunu sonucunu ortaya koydu.
- Elektron negatif yüklü olduğu için elektriksel alanda pozitif kutba doğru sapar. Elektriksel alandaki bu sapmalar taneciğin yükü (e) ile doğru, kütlesi(m) ile ters orantılıdır. Yükün kütleye oranı (e/m) bir elektirik alanı içinde elektronların doğrusal yoldan ne kadar sapacağını gösterir.
Katot Işınları
Elektronların özelliği, atom hakkındaki bilgiler ve X ışınlarının keşfi, elektriğin gazlar içerisinden geçişinin incelenmesiyle bulunmuştur. Normal basınçta gazlar iyi iletken değildir. Ama gazın basıncı azaltılırsa iletkenliği arttar. Mesela bir cam borunun havası alınıp, içindeki basınç 10 mm civa (Hg)’ ya düşürülsün. Camın iki yanına elektrot bağlanıp,10.000 voltluk bir gerilim tatbik edildiğinde, boru içindeki gaz ışık yayar. Işığın rengi boru içindeki gazın cinsine bağlıdır (renkli reklam lambaları). Basınç 0,01 mm civadan aşağı düşerse tüp karanlık olur. Buna karşın katodun karşısındaki cam hafif yeşilimsi floresana verir. Burada katottan çıkan ışınlar cama sürekli ışıklar gönderir, bu da floresana sebep olmaktadır ki bu ışınlara, katot ışınları adı verilir.
Katot ışınlarının meydana gelmesi, gazın iyonlaşmasından olur. Bir gaz molekülünün iyonlaşması, bu molekülden elektronların ayrılmasıdır. 1895’ de katot ışınlarının, bir manyetik alandan geçirilerek pozitif kutba doğru ilerledikleri ve bundan dolayı negatif yüklü partiküllerden meydana geldiği anlaşılmıştır. Daha sonra bu partiküllerin elektrik ve manyetik alan da saptırılmasıyla hızları bulunmuş ve bunlara elektron adı verilmiştir.
Elektronların Kuantum Teorisi
Atom teorisinde gelişmenin ilk adımı Niels Bohr tarafından atılmıştır. Bohr atom yapısı için planet sisteminin klasik elektromekanik teoriye göre kararlı olmadığını biliyordu. Zira devamlı ışıma, devamlı enerji kaybıdır. Bu durumda enerjisi devamlı azalan elektron çekirdeğe gittikçe yaklaşmalıydı. Öte yandan atom yapısının planet sistemine benzediği de çok kesindi. Niels Bohr elektromekanik kanunlarının atomlara tatbik edilemeyeceğini, buna karşılık kuantum mekaniğinin geçerliliğini söylemiştir.
Heisenberg Belirsizlik Prensibi
Elektronun bir dalga ve bir tanecik gibi davrandığı gözlemlenmiştir. Belirsizlik prensibi, herhangi bir deneyde bir elektronun aynı zamanda hem bir dalga hem de bir tanecik olarak hareket edemeyeceğini gösterir. Bir elektronun yeri belirlenmek istendiği zaman momentum, momentum belirlenmek istendiğinde ise yeri kaybedilmektedir. Heisenberg belirsizlik prensibi’ ne göre, bir taneciğin hareketini belli eden enerjisi yada momentum ile yerinin aynı zamanda büyük bir doğrulukta tayini mümkün olmamaktadır.
Atom, mikroskobik olarak ölçülebildiği için 3 boyutlu olarak kabul edilmektedir. Bu da, proton ve nötronun da 3 boyutlu olduğu anlamına gelmektedir. Elektron ile birlikte atomda daha başka temel parçacıklar da bulunmaktadır: Kuark ve gluon. Kuark, proton ve nötronu oluşturan temel parçacıktır ve gluon ise kuarkları birbirine bağlanmasını sağlar. Maddenin temel parçacıklarını oluşturan elektron, kuark ve gluon ise tek boyutlu yani nokta parçacıklardır. Nokta parçacıkların boyutunu anlayabilmenin yolu ise, CERN’de bulunan hızlandırıcı gibi hızlandırıcılarda bu parçacıkları kafa kafaya çarpıştırmaktır. Kafa kafaya çarpışan parçacıklar, daha küçük parçacıklara dönüşüyorsa, bu, parçacığın tek boyutlu olduğu anlamına gelmektedir.
Faydalı bilgiler : Kablo Seçim Cetveli | PLC | HMI | SCADA | Endüstri 4.0 | Servo motor | AC motor | Step motor | DC motor | Loadcell | Konveyör | Profinet | Direnç değeri okuma |







Yorum Yok