iyonik bağ
iyonik bağ nedir?
İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ çeşididir. En dıştaki yörüngeleri dolu olan atomlar oldukça kararlı durumdadırlar, başka atomlarla bileşik oluşturma eğilimi göstermezler.
Sadece soygazların yörüngeleri tamamen doludur, diğer grupların dış kabuklarında eksik ya da fazla elektron bulunmaktadır. Oysa atom, tüm yörüngelerinin dolu olması yönelimindedir ve eğer dolu değilse bunu sağlamaya yönelecektir. Bu konumda atomun başına iki farklı olay gelebilir, dış kabuktaki elektronlardan kurtularak zaten dolu olan bir alttaki kabuğu son kabuk haline getirmek ya da dış kabuğu dışarıdan elektron alarak tamamlamak.
Elektron verme eğiliminde olan bir atomla elektron alma eğilimindeki bir atom reaksiyon alanına girdiklerinde, aralarında bir elektron alışverişi olur. Bunun sonucunda elektron alan atom negatif (-) iyon (anyon), elektron veren atom ise pozitif (+) iyon (katyon) haline gelecektir. Atomlardan elektron kaybı ile oluşan pozitif iyonlara katyon, atomların elektron kazanarak oluşturdukları negatif iyonlara da anyon denir. Bu şekilde aralarında elektrostatik çekme kuvveti oluşan atomlar iyonik bağlı bir bileşik oluştururlar. Metaller ile ametaller arasında gerçekleşir ve metallerin elektron vermesi, ametallerin ise elektron almasıyla oluşur. Bu iyonlar bir araya getirildiklerinde bir kristal oluşturmak üzere birbirlerini çekerler.
İyonik Bağ Örnekleri
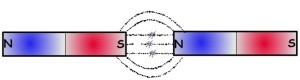
İyonik bağda “+” ve “– “yüklü iyonlar da tıpkı mıknatısın kutupları gibi birbirlerini çekerler.
İyonik Bağlar ve Özellikleri
- Katı halde genel olarak elektriği iletmezler ama sulu çözeltilerinde ve erimiş halde iyonlarına ayrıştıkları için elektrik akımını iletirler.
- İyonik bağlar sert ve kırılgandırlar, tel ve levha haline getirilemezler, herhangi bir zorlamada kırılırlar.
- İyonik bileşiklerin formülünü yazarken katyon başa gelir.
- Elektroliz edilebilirler
- İyonik bileşikler oda sıcaklığında genellikle katı halde ve kristal yapıda bulunur.
İyonik bağlanma yalnızca, bağlanmış atomlar serbest olanlardan daha düşük enerjiye sahip olduklarında ve reaksiyonun toplam enerji değişimi, reaksiyonun gerçekleşmesi yönünde ise oluşur. Toplam enerji değişimi ne kadar büyükse, bağ o kadar güçlüdür. Tüm iyonik bağlar bir tür kovalent bağ veya metalik bağ özelliği taşırlar. İki atom arasındaki elektronegatiflik farkı ne kadar büyükse bağ da o kadar iyoniktir.
İyonik bağlı bileşiklere örnekler;
NaCl, MgS, BaCl2, NaOH, NH4NO2, FeO, KCl, FeS, MgF2, K2S, LiF, NaF, KF ……
İyonik Bağ Nasıl Oluşur?
İyonik bağ oluşumunda, metal, düşük elektronegatifliği sebebiyle bir elektron vererek pozitif bir iyon (katyon) oluşturur. Normal sofra tuzunda, sodyum ile klor iyonları birbirlerine iyonik bağ ile bağlıdır. İyonik bağ genel olarak metallerle ametaller arasında gerçekleşir. Ametal atomlarının elektronegatifliği yüksektir ve kolayca elektron alıp negatif iyon (anyon) oluşturabilirler. Bundan dolayı, iki veya daha fazla iyon, elektrostatik kuvvetlerin etkisiyle birbirlerini çekerler. Bu tür bağlar, hidrojen bağından daha kuvvetli fakat kovalent bağ ile hemen hemen aynı kuvvettedir.
A gruplarındaki elementlerin bileşikleri çoğu defa elementlerin simgeleri ile birlikte değerlik elektronlarını gösteren noktalar kullanılarak tanımlanır. Değerlik elektronları baş grup (A grubu) elementlerinin kimyasal tepkimelerinde kullanılan elektronlardır.
Örnek verirsek; bir sodyum atomu ile bir klor atomu (NaCl) arasındaki tepkimeyi ele aldığımızda;
Sodyum 1A grubundadır sadece bir değerlik elektronuna sahiptir. Klor atomu ise 7A grubundadır 7 değerlik elektronuna sahiptir. Bu iki atom arasındaki tepkimede sodyum atomu 1 elektron kaybeder, sodyum atomunun kaybetmiş olduğu elektronu klor atomu kazanır.
Sodyum çekirdeği 11 proton (11+ yük) ve sodyum iyonu da sadece 10 elektron (bir elektron kaybetmiş oluyor) içerdiğinden sodyum atomunun bir elektron kaybetmesiyle 1+ yüklü sodyum iyonu oluşur. Diğer taraftan, klor çekirdeği 17 proton (17+ yük) ve klor iyonun da 18 elektron (bir elektron kazanılmış oluyor) içerdiğinden klor atomunun bir elektron kazanmasıyla da 1- yüklü bir klorür iyonu oluşur.
Sodyumun (Na) Na+ İyonuna Dönüşmesi
11 elektronlu sodyum atomu 1 elektron vererek kararlı hale gelir.
Sodyum ve Klor Atomlarının Arasında İyonik Bağ Oluşumu
Sodyum ve klor atomları, arasında iyonik bağ yaparak NaCl bileşiğini oluşturur.
Na + Cl Na+1 + Cl–1 NaCl
Görüldüğü üzere, bu tepkime sonucu, sodyum tarafından kaybedilen elektronların toplam sayısı klor tarafından kazanılan elektronların toplam sayısına eşit olmalıdır. Böylece oluşan sodyum iyonlarının sayısı ile oluşan klorür iyonlarının sayısı aynı olduğu için NaCl formülü bileşikte bulunan iyonların en basit oranını (1:1) verir. Bu iyonlar bir kristal oluşturmak üzere birbirini çekerler.
Sodyum klorür kristalinde bir iyonun tümüyle diğer bir iyona ait olduğu söylenemez. Aksine, kristal yapıda her bir sodyum iyonu altı klorür iyonu ile her bir klorür iyonu da altı sodyum iyonu ile çevrilmiştir. Kristal içerisinde iyonların bu şekilde düzenlenmesi ile benzer yüklü iyonların birbirlerini itmeleri, zıt yüklü iyonların birbirlerini çekmeleri tarafından bastırıldığı için net çekim kristali bir arada tutar.
İyonik Bağlı Bileşiklerde Kristal Yapı
İyonik bağlı bileşiklerde iyonlar birbirini en kuvvetli şekilde çekecek bir düzen içinde dizilirler. Böyle düzenli birleşen atomlardan kristal yapı denilen düzgün geometrik şekiller oluşur. Yemek tuzunun kristal yapısı buna örnektir. Yemek tuzundaki (NaCl) kristal yapı, şekildeki gibidir.
İyonik Bağların Sağlamlığı
İyonik bağın sağlamlığı:
- İyonların yüklerinin çarpımının mutlak değerine,
- İyon yarı çapına bağlıdır
Çünkü Coulomb kanununa göre çekim kuvveti yüklerin büyüklüğüyle doğru orantılı, yükler arası uzaklığın karesiyle ters orantılıdır. İyonik bağın sağlamlığı bileşiğin erime noktasına bakılarak anlaşılabilir. Erime noktası yüksek olan bileşiklerin iyonik bağı da kuvvetlidir.
İyonik bağlı bileşiklerin sağlamlığı iyonların yarıçapı arttıkça iyonlar arasındaki elektrostatik çekim gücü azaldığı için iyonik bağın gücü azalır. Ayrıca iyon yükü arttıkça iyonik bağın kuvveti de artar. İyonik bağ kuvveti artar .
Örnek olarak; Ca2+ ve Ba2+ iyonları O2- ile iyonik bağ yapınca yükler eşit olmasına rağmen Ca2+ nun iyon yarıçapı daha küçük olduğu için CaO daha sağlamdır ve erime noktası daha yüksektir.
Kutuplaşma (polarizasyon) Etkisi
İyonik bileşiklerin kristal yapısı içindeki iyonlar küreseldir ama, eğer artı iyon küçük ve/veya yüksek oranda yüklü ise, eksi iyonun elektron bulutunu bozar. Eksi iyonun bu şekilde kutuplaşması, iki atomun çekirdekleri arasında ek yük birikimine yol açar ki bu da kısmi kovalent bağ demektir.
Boyutça büyük eksi iyonlar daha kolaylıkla polarize olurlar. Ama bu durum, sadece 3+ değerlikli artı iyon (örnek, Al3+) söz konusu olduğunda önemlidir (örnek, saf AlCl3 kovalent bir moleküldür). Diğer yandan, 2+ yüklü iyonlar (Be2+) hatta 1+ yüklü iyonlar (Li+) dahi, boyutları çok küçük olduğu için bir miktar kutuplaştırma (polarize etme) gücüne sahiptirler (örnek, LiI iyoniktir ama bazı kovalent özellikler gösterir). “Kutuplaştırma gücü”, iyonun yükü ile boyutu arasındaki orana bağlı olup yük yoğunluğu olarak adlandırılır.
Sodyum ve klor atomlarının sodyum klorid oluşturmak üzere iyonik bağla bağlanışı. Sodyum en dıştaki atomunu kaybeder ve asal gaz elektron konfigürasyonuna sahip olur. Bu elektron egzotermik olarak klor atomuna girer. Ardından, zıt yüklü iyonlar birbirini çeker ve iyonik bağ oluşur.
Klor atomunun, sodyum atomunun son katmanındaki bir elektronu alarak negatif yükle yüklenir. Böylece klor anyonu oluşur. Sodyum atomu ise bir elektonu eksildiği için pozitif yükle yüklenerek sodyum katyonunu oluşturur. Oluşan anyon ve katyon zıt yüklere sahip oldukları için birbirini çeker. Anyon ve katyon arasındaki bu çekim kuvvetli bir kimyasal bağdır ve bu kimyasal bağa iyonik bağ denir.
Kovalent Bileşiklerle Karşılaştırılması
İyonik bir bağ durumunda atomlar, zıt yüklü iyonların çekimi ile birbirine bağlı iken, kovalent bağ durumunda atomlar, elektron paylaşımı yoluyla bağlanırlar. Kovalent bağ durumunda, her atomun etrafındaki moleküler geometri, VSEPR kuralları ile belirlenirken, iyonik malzemelerde geometri, maksimum sıkı paket kurallarını takip eder. Bundan dolayı bir bileşiğin iyonik veya kovalent olarak sınıflandırılması vardır.
Faydalı bilgiler : Kablo Seçim Cetveli | PLC | HMI | SCADA | Endüstri 4.0 | Servo motor | AC motor | Step motor | DC motor | Loadcell | Konveyör | Profinet | Direnç değeri okuma |







Yorum Yok